Архивы рубрики ‘Практикующему врачу полный текст’
Сахарный диабет и риск внебольничной бактериемии, вызванной Staphylococcus aureus: результаты популяционного исследования типа случай-контроль
У пациентов с сахарным диабетом может быть более высокий риск бактериемии, вызванной Staphylococcus aureus, по сравнению с пациентами без диабета.  Это связано со снижением иммунитета и сопутствующими заболеваниями.
Это связано со снижением иммунитета и сопутствующими заболеваниями.
В исследовании, опубликованном в мартовском номере журнала European Journal of Endocrinology, изучался риск внебольничной бактериемии, вызванной S. aureus, у пациентов с сахарным диабетом и без него.
Золотистый стафилококк остаётся лидирующей причиной бактериемии, приводящей к 20−30% 30-дневной летальности. Несмотря на то, что уже давно предполагалось, что сахарный диабет повышает риск инфекции, вызванной S. aureus, убедительных доказательств для данного утверждения не было.
Используя популяционные базы медицинских данных, было проведено исследование типа случай-контроль у всех госпитализированных в стационарах взрослых с впервые диагностированной внебольничной бактериемией, вызванной S. aureus, и соответствующей контрольной группой в Северной Дании за период 2000—2001 гг. Случаи нозокомиальной стафилококковой бактериемии в анализ не включались.
На основании условной логистической регрессии было рассчитано отношение шансов (ОШ) развития внебольничной бактериемией, вызванной S. aureus, у пациентов с диабетом. В дальнейшем была проведена оценка риска внебольничной бактериемией, вызваннойS. aureus, в зависимости от различных характеристик заболевания у пациентов (длительность сахарного диабета, гликемического контроля, наличия осложнений диабета).
Сопутствующие заболевания, связанные с диабетом, включая диабетическую стопу, поражение почек и потенциальное снижение иммунитета на фоне диабета, могут рассматриваться в качестве возможных причин развития бактериемии, однако на настоящий момент недостаточно данных для изучения такого рода возможных причин бактериемии.
Всего было идентифицировано 2638 пациентов с внебольничной бактериемией, вызванной S. aureus, из которых у 713 человек (27%) был диагностирован диабет; группу контроля составили 26379 человек (2495 или 9,5% с сахарным диабетом), т.е. на каждый случай бактериемии было подобрано 10 контрольных пациентов, соответствующих по возрасту, полу и месту проживания.
У всех пациентов сахарный диабет был диагностирован до момента госпитализации по поводу бактериемии либо по уровню гликированного гемоглобина (HbA1c) ≥6,5%, либо по назначению противодиабетических препаратов.
У пациентов с диабетом отмечался существенно более высокий риск возникновения внебольничной стафилококковой бактериемии по сравнению с популяционным контролем (скорректированное ОШ 2,8, 95% ДИ 2,5−3,1). Длительность заболевания ≥10 лет и недостаточный гликемический контроль значительно повышали расчетное значение риска (скоррегированное ОШ 2,3, 95% ДИ 1,9−2,7) для диабета с уровнем гликированного гемоглобина <7% и скорректированное ОШ 5,7 (95% ДИ 4,2−7,7) для пациентов с HbA1c ≥9%). Риск внебольничной стафилококковой бактериемии был особенно высок у тех пациентов с сахарным диабетом, у которых развились осложнения. Так, у пациентов с микрососудистыми осложнениями скорректированное ОШ составило 5,5 (95% ДИ 4,2−7,2), а у лиц с комбинированными (микро-и макроваскулярными) сосудистыми осложнениями ОШ=7,0 (95% ДИ 5,4−9,0).
Интересен тот факт, что диагноз сахарного диабета I типа повышает риск стафилококковой бактериемии в 7 раз (ОШ=7,2) по сравнению с контролем, а у пациентов с СД II типа только в 2,7 раза.
Кроме стафилококковой бактериемии у пациентов с сахарным диабетом также повышается риск возникновения и других инфекционных заболеваний, в частности, бактериемии, вызванной гемолитическими стрептококками групп B и G, а также пневмококковой бактериемии. В недавно опубликованных статьях на Medscape Medical News также было показано, что у пациентов с сахарным диабетом на 50% повышается риск развития инфекции в области хирургического вмешательства по сравнению с пациентами без диабета.
Таким образом, данное описательное исследование продемонстрировало, что сахарный диабет приводит к существенному повышению риска развития внебольничной бактериемии, вызванной S. aureus, особенно у пациентов с длительным анамнезом диабета, недостаточным гликемическим контролем и наличием диабетических осложнений.
Источник:
Smit J., Søgaard M., Schønheyder H.C., Nielsen H., Frøslev T., Thomsen R.W.
Diabetes and risk of community-acquired Staphylococcus aureus bacteremia: A population-based case-control study.
Eur J Endocrinol. 2016 Mar 10.
Антибиотики — нераспознанная причина делирия
Делирий (или острое психическое расстройство с проявлениями возбуждения, с иллюзиями, галлюцинациями) рассматривается как нередкое осложнение, возникающее в ходе госпитализации пациента. Хотя приём лекарственных препаратов — это известная причина делирия, антибиотики на настоящий момент являются нераспознанным классом лекарственных средств, вызывающих делирий. Результаты обзора, посвящённого данной проблеме, опубликованы в февральском номере журнала Neurology.
Хотя приём лекарственных препаратов — это известная причина делирия, антибиотики на настоящий момент являются нераспознанным классом лекарственных средств, вызывающих делирий. Результаты обзора, посвящённого данной проблеме, опубликованы в февральском номере журнала Neurology.
Несмотря на то, что серьёзные нежелательные лекарственные реакции (НЛР) со стороны центральной нервной системы, возникающие на фоне применения антибиотиков, возникают достаточно редко, а энцефалопатия является очень малой частью такого рода НЛР, в одном недавно опубликованном исследовании было показано, что частота развития энцефалопатии у пациентов в критическом состоянии достигает 15% и что чаще всего она ассоциирована с применение цефалоспорина IV поколения цефепима.
Для выполнения нового обзора исследователи провели поиск литературы и идентифицировали 391 случай за период с 1946 по 2013 гг., в котором были описано возникновение у пациентов делирия или нарушения когнитивной функции или сознания после начала антибактериальной терапии, с уменьшением интенсивности возникших НЛР со стороны ЦНС после прекращения лечения антибиотиком. В обзор не включались данные о пациентах, у которых энцефалопатия отмечалась до начала антибактериальной терапии.
Вероятность того, что именно антибиотик явился причиной развития данного нежелательного эффекта, определялась с использованием Шкалы вероятности развития нежелательных лекарственных реакций Naranjo (Naranjo Adverse Drug Reaction Probability Scale). Среди пациентов 54% составили мужчины, средний возраст — 54 года. Всего во включённых в обзор случаях использовалось 54 различных антибактериальных препарата, относящихся к 12 классам.
При проведении оценки разнообразия клинических характеристик случаев возникновения поражений ЦНС на фоне АБ терапии, было выделено 3 отдельных клинических синдрома антибиотик-ассоциированной энцефалопатии (ААЭ):
- Тип 1 ААЭ: его развитие связано с применением пенициллинов и цефалоспоринов и характеризуется возникновением симптомов в течение нескольких дней после начала антибактериальной терапии. Клинические характеристики 1 типа ААЭ включают развитие спазма мускулатуры или судорог, отклонения на ЭЭГ, однако при проведении МРТ патологические изменения отсутствуют (как правило, отмечается нормальная МРТ-картина). Симптомы разрешаются обычно в течение нескольких дней. Энцефалопатия, возникающая на фоне применения цефалоспоринов, наиболее часто развивается при почечной недостаточности. Что касается патофизиологических аспектов, то при типе 1 ААЭ идет нарушение ингибирующей синаптической передачи, что приводит к возникновению эксайтотоксичности (т.е. токсичности, развивающейся при возбуждении).
- Тип 2 ААЭ: возникает на фоне применения бензилпенициллина прокаина, сульфаниламидов, фторхинолонов и макролидов. Симптомы возникают также в течение нескольких дней после начала антибактериальной терапии и включают психоз и (значительно реже) развитие судорог. Также 2 тип ААЭ характеризуется нечасто регистрируемыми отклонениями на ЭЭГ, нормальной МРТ картиной и разрешается в течение нескольких дней. Тип 2 ААЭ очень похож на лекарственно-индуцированные психотические синдромы, вызванные сокращением D2 рецепторов к дофамину и NMDA глутаматных рецепторов (аналогичное состояние вызывают кокаин, амфетамин и фенциклидин).
- Тип 3 ААЭ: возникает только на фоне применения метронидазола. Начало, как правило, спустя несколько недель после назначения антибиотика. Синдром часто характеризуется мозжечковой дисфункцией и реже судорогами или отклонениями на ЭЭГ. Токсичность метронидазола приводит к возникновению характерных обратимых сигнальных изменений на МРТ в зубчатых ядрах мозжечка, задней части ствола головного мозга или валике мозолистого тела.
Вне этих 3 типов ААЭ находится изониазид, который приводит к возникновению симптомов спустя недели и даже месяцы после начала применения препарата и характеризуется развитием психоза. Судороги на фоне применения изониазида возникают редко, однако на ЭЭГ обычно обнаруживаются отклонения. В данное описание не включены случаи интоксикации изониазидом, связанные с его передозировкой.
Клиницистам следует помнить о возможности развития антибиотик-ассоциированной энцефалопатии, а характеристики перечисленных типов нейротоксичности антибиотиков могут помочь правильно и своевременно установить диагноз ААЭ, вовремя отменить причинно-значимый антибактериальный препарат и сократить продолжительность делирия у пациента.
Источник:
Bhattacharyya S., Darby R.R., Raibagkar P., Gonzalez Castro L.N., Berkowitz A.L.
Antibiotic-associated encephalopathy.
Neurology. 2016 Feb 17.
Последствия избегания применения β-лактамных антибиотиков у пациентов с аллергическими реакциями на β-лактамы
Выбор эмпирической антибактериальной терапии для лечения инфекций кровотока, вызванных грамотрицательными возбудителями, у пациентов с аллергическими реакциями на β-лактамные антибиотики нередко является трудным решениям для врача, поскольку именно β-лактамы рассматриваются в качестве препаратов первой линии для терапии такого рода состояний в большинстве клинических рекомендаций.
вызванных грамотрицательными возбудителями, у пациентов с аллергическими реакциями на β-лактамные антибиотики нередко является трудным решениям для врача, поскольку именно β-лактамы рассматриваются в качестве препаратов первой линии для терапии такого рода состояний в большинстве клинических рекомендаций.
Ежегодно около 500 тыс. пациентов в США, госпитализируемых в стационар, сообщают о наличии у них аллергических реакций на препараты первой линии, причём наиболее часто сообщают об аллергии на пенициллин. Кроме пенициллинов, группа β-лактамов включает также цефалоспорины и карбапенемы. В случае, если у пациента имеется запись о непереносимости β-лактамов, ему, как правило, назначаются антимикробные препараты других групп, которые являются препаратами второго ряда для терапии большинства серьёзных инфекций. Наиболее часто аллергические реакции возникают на пенициллины или цефалоспорины и проявляются сыпью, зудом, анафилаксией, реже другими реакциями.
Целью ретроспективного исследования, проведённого на базе 3 медицинских академических центров в США, было сравнение частоты клинической неэффективности терапии у взрослых пациентов с анамнестическими данными непереносимости β-лактамов, которые получали либо β-лактамные антибиотики, либо антимикробные препараты других групп. Результаты данной работы были опубликованы в декабрьском номере журнала JournalofAllergyandClinicalImmunology.
В ходе исследования группы лечения были классифицированы как β-лактамы или не-β-лактамы на основании эмпирического выбора антибиотиков. Клиническая неэффективность оценивалась спустя 72−96 ч после начала антибиотикотерапии. В качестве признаков клинической неэффективности лечения рассматривались лихорадка 38,0°C и выше, необходимость применения или повышение потребности в использовании вазопрессоров, перевод в отделения интенсивной терапии, необходимости проведения механической вентиляции или летальный исход. Также в ходе исследования регистрировались реакции гиперчувствительности, если они возникали у пациента на фоне назначенной антибактериальной терапии.
Всего в анализ были включены данные 552 пациентов: 433 пациента в группе применения β-лактамов (78,4%) и 119 пациентов — в группе не-β-лактамов (21,6%). Как оказалось, частота клинической неэффективности терапии была выше в группе применения не-β-лактамных антибиотиков (38,7% vs 27,4%, р=0,03). Также в группе не-β-лактамов была более низкая частота перекрытия эмпирически назначенным антибиотиком выделенных в последующем патогенов (74,8% vs 91,7%, p<0,001).
Наиболее распространённым проявлением клинической неэффективности было повышение температуры выше 38,0°C спустя 72−96 ч после начала эмпирической антибактериальной терапии (группа не-β-лактамов — 22,7% vs 13,9% в группе β-лактамов, р=0,016). После корректировки данных по механической вентиляции, применению вазопрессоров и оценки по шкале APACHE II оказалось, что при применении не-β-лактамов частота клинической неэффективности терапии увеличивается практически в 2 раза (скоррегированное отношение шансов 1,9, р=0,012).
Реакции гиперчувствительности возникли у 16 из 552 пациентов (2,9%), из них у 13 пациентов (2,5%) реакции гиперчувствительности возникли на фоне применения β-лактамов при терапии инфекций кровотока, вызванных грамотрицательными возбудителями. Тем не менее, не было зарегистрировано ни одного случая летального исхода от развития аллергической реакции на β-лактамы.
Таким образом, у пациентов с анамнестическими данными аллергических реакций на β-лактамы и наличием инфекций кровотока, вызванных грамотрицательными возбудителями, использование данной группы антимикробных препаратов ассоциируется с более низкой частотой клинической неэффективности терапии. Низкая частота возникновения реакций гиперчувствительности предоставляет дальнейшие доказательства о достаточно низком риске развития перекрёстных аллергических реакций между различными классами β-лактамов. Результаты данного исследования поддерживают имеющуюся практику использования именно β-лактамов, а не альтернативных антимикробных препаратов других групп в случаях, когда нужно перекрытие грамотрицательных патогенов.
JeffresM.N., Narayanan P.P., Shuster J.E., Schramm G.E.
Consequences of avoiding β-lactams in patients with β-lactam allergies.
J Allergy ClinImmunol.2015 Dec 11.
По материалам antibiotic.ru
Применение антиинфекционных химиопрепаратов у пациентов с почечной и печеночной недостаточностью
При нарушении функции печени — основного метаболизирующего органа — инактивация некоторых антибиотиков (макролиды, линкозамиды, тетрациклины и др.) может существенно замедляться, что сопровождается увеличением концентрации препаратов в сыворотке крови и повышением риска их токсического воздействия. Кроме того, в условиях печеночной недостаточности риску нежелательного влияния таких АМП подвергается и сама печень, что приводит к дальнейшему нарушению функций гепатоцитов и создает угрозу развития печеночной комы. Поэтому при клинических и лабораторных признаках печеночной недостаточности (повышение уровня билирубина, активности трансаминаз, изменения холестерина, белкового обмена) для АМП, метаболизирующихся в печени, следует предусмотреть уменьшение дозы. Однако единых рекомендаций коррекции режима дозирования и четких критериев, определяющих степень снижения доз в зависимости от выраженности проявлений печеночной недостаточности, не существует. В каждом конкретном случае следует сопоставлять риск и пользу от предполагаемого назначения АМП.
Кроме того, в условиях печеночной недостаточности риску нежелательного влияния таких АМП подвергается и сама печень, что приводит к дальнейшему нарушению функций гепатоцитов и создает угрозу развития печеночной комы. Поэтому при клинических и лабораторных признаках печеночной недостаточности (повышение уровня билирубина, активности трансаминаз, изменения холестерина, белкового обмена) для АМП, метаболизирующихся в печени, следует предусмотреть уменьшение дозы. Однако единых рекомендаций коррекции режима дозирования и четких критериев, определяющих степень снижения доз в зависимости от выраженности проявлений печеночной недостаточности, не существует. В каждом конкретном случае следует сопоставлять риск и пользу от предполагаемого назначения АМП.
Замедленное выведение АМП и их метаболитов при почечной недостаточности повышает риск их токсического воздействия как на отдельные системы, так и на организм в целом. Чаще всего страдают ЦНС, кроветворная и сердечнососудистая системы. Выведение АМП и их метаболитов с мочой зависит от состояния клубочковой фильтрации, канальцевой секреции и реабсорбции. При почечной недостаточности период полувыведения многих АМП может удлиняться в несколько раз. Поэтому перед назначением препаратов, которые активно выводятся с мочой (аминогликозиды, β-лактамы и др.), необходимо определить клиренс креатинина и при его снижении либо уменьшить суточные дозы антибиотиков, либо увеличить интервалы между отдельными введениями. Это особенно актуально при тяжелой почечной недостаточности с дегидратацией, когда даже первая доза должна быть снижена. В ряде случаев, если имеются выраженные отеки, может потребоваться обычная (или даже несколько завышенная) первоначальная доза, которая позволит преодолеть избыточное распределение препарата в жидкостях организма и достичь нужной концентрации (бактерицидной или бактериостатической) в крови и тканях.
В таблице указаны дозы АМП в зависимости от степени выраженности недостаточности функции почек. Некоторые препараты не включены в таблицу, а описание методики дозирования приводится в информации на соответствующий АМП.
Таблица. Дозирование антинфекционных препаратов у пациентов с почечной и печеночной недостаточностью
| Препарат | Изменение дозировки при клиренсе креатинина * | Необходимость в изменении дозировки при недостаточности функции печени ** | ||
| > 50 мл/мин | 10−50 мл/мин | < 10 мл/мин | ||
| Пенициллины | ||||
| Азлоциллин | 100% каждые 4−6 ч | 100% каждые 6−8 ч | 100% каждые 8−12 ч | - |
| Амоксициллин | 100% каждые 8 ч | 100% каждые 8−12 ч | 100% каждые 24 ч | - |
| Амоксициллин/клавуланат | 100% каждые 8 ч | 100% каждые 8−12 ч | 100% каждые 24 ч | - |
| Ампициллин | 100% каждые 6 ч | 100% каждые 6−12 ч | 100% каждые 12−24 ч | - |
| Ампициллин/сульбактам | 100% каждые 6−8 ч | 100% каждые 12 ч | 100% каждые 24−48 ч | - |
| Бензилпенициллин | 100% каждые 4−6 ч | 75% каждые 4−6 ч | 20−50% каждые 4−6 ч | - |
| Карбенициллин | 100% каждые 4−6 ч | 75% каждые 6−8 ч | 50% каждые 8 ч | - |
| Оксациллин | 100% каждые 4−6 ч | 100% каждые 6 ч | 100% каждые 6 ч | - |
| Пиперациллин | 100% каждые 4−6 ч | 100% каждые 6−8 ч | 100% каждые 12 ч | - |
| Пиперациллин/тазобактам | 100% каждые 6 ч | 60−70% каждые 6 ч | 60−70% каждые 8 ч | - |
| Тикарциллин/клавуланат | 100% каждые 4 ч | 60−70% каждые 4−8 ч | 60−70% каждые 12 ч | - |
| Феноксиметилпенициллин | 100% каждые 6 ч | 100% каждые 6 ч | 100% каждые 6 ч | - |
| Цефалоспорины | ||||
| Цефадроксил | 100% каждые 12 ч | 100% каждые 12−24 ч | 100% каждые 24−48 ч | - |
| Цефазолин | 100% каждые 8 ч | 50−100% каждые 8−12 ч | 50% каждые 18−24 ч | - |
| Цефаклор | 100% каждые 8 ч | 50−100% каждые 8 ч | 50% каждые 8 ч | - |
| Цефалексин | 100% каждые 8 ч | 100% каждые 12 ч | 100% каждые 12 ч | - |
| Цефепим | 100% каждые 12 ч | 100% каждые 16−24 ч | 100% каждые 24−48 ч | - |
| Цефиксим | 100% каждые 12 ч | 75% каждые 12 ч | 50% каждые 12 ч | - |
| Цефоперазон | 100% каждые 12 ч | 100% каждые 12 ч | 100% каждые 12 ч | + |
| Цефоперазон/сульбактам | 100% каждые 12 ч | 50% каждые 12 ч | 25% каждые 12 ч | + |
| Цефотаксим | 100% каждые 6 ч | 100% каждые 8−12 ч | 100% каждые 24 ч | - |
| Цефтазидим | 100% каждые 8−12 ч | 50−75% каждые 12−24 ч | 25−50% каждые 24−48 ч | - |
| Цефтибутен | 100% каждые 24 ч | 100% каждые 48 ч | 50−100% каждые 48−96 ч | - |
| Цефтриаксон | 100% каждые 24 ч | 100% каждые 24 ч | 100% каждые 24 ч | - |
| Цефуроксим | 100% каждые 8 ч | 50−100% каждые 12 ч | 50% каждые 24 ч | - |
| Карбапенемы | ||||
| Имипенем | 100% каждые 6 ч | 50% каждые 8−12 ч | 25−50% каждые 12 ч | - |
| Меропенем | 100% каждые 6 ч | 50% каждые 12 ч | 50% каждые 24 ч | - |
| Монобактамы | ||||
| Азтреонам | 100% каждые 8−12 ч | Нагрузочная доза 100%, затем 50% нагрузочной дозы каждые 6−12 ч | Нагрузочная доза 50%, за-тем 25% нагрузочной дозы каждые 6−12 ч | + |
| Макролиды и азалиды | ||||
| Азитромицин | 100% каждые 24 ч | 100% каждые 24 ч | 100% каждые 24 ч | + |
| Джозамицин | 100% каждые 8−12 ч | 100% каждые 8−12 ч | 100% каждые 8−12 ч | + |
| Кларитромицин | 100% каждые 12 ч | 75% каждые 12 ч | 50% каждые 12 ч | + |
| Мидекамицин | 100% каждые 8 ч | 100% каждые 8 ч | 100% каждые 8 ч | + |
| Рокситромицин | 100% каждые 12 ч | 100% каждые 12 ч | 100% каждые 12 ч | + |
| Спирамицин | 100% каждые 12 ч | 100% каждые 12 ч | 100% каждые 12 ч | Не применяется |
| Эритромицин | 100% каждые 6 ч | 100% каждые 6 ч | 50−75% каждые 6 ч | Не применяется |
| Аминогликозиды | ||||
| Амикацин | Нагрузочная доза, затем 50−90% нагрузочной дозы каждые 12−24 ч | Нагрузочная доза, затем 10−50% нагрузочной дозы каждые 24−72 ч | Нагрузочная доза, затем 10% нагрузочной дозы каждые 72−96 ч | - |
| Гентамицин | Нагрузочная доза, затем 80−90% нагрузочной дозы каждые 8−12 ч | Нагрузочная доза, затем 35−80% нагрузочной дозы каждые 12 ч или 60−90% каждые 24 ч | Нагрузочная доза, затем 10−35% нагрузочной дозы каждые 12 ч или 20−60% каждые 24 ч | - |
| Канамицин | Нагрузочная доза, затем 80−100% нагрузочной дозы каждые 8−12 ч | Нагрузочная доза, затем 35−80% нагрузочной дозы каждые 12 ч или 60−90% каждые 24 ч | Нагрузочная доза, затем 10−35% нагрузочной дозы каждые 12 ч или 20−60% каждые 24 ч | - |
| Нетилмицин | Нагрузочная доза, затем 55−80% нагрузочной дозы каждые 8−12 ч | Нагрузочная доза, затем 15−50% нагрузочной дозы каждые 12 ч | Нагрузочная доза, затем 10% нагрузочной дозы каждые 24−48 ч | - |
| Стрептомицин | Нагрузочная доза, затем 80−90% нагрузочной дозы каждые 8−12 ч | Нагрузочная доза, затем 35−80% нагрузочной дозы каждые 12 ч или 60−90% каждые 24 ч | Нагрузочная доза, затем 10−35% нагрузочной дозы каждые 12 ч или 20−60% каждые 24 ч | - |
| Тобрамицин | Нагрузочная доза, затем 80−90% нагрузочной дозы каждые 8−12 ч | Нагрузочная доза, затем 35−80% нагрузочной дозы каждые 12 ч или 60−90% каждые 24 ч | Нагрузочная доза, затем 10−35% нагрузочной дозы каждые 12 ч или 20−60% каждые 24−48 ч | - |
| Тетрациклины | ||||
| Доксициклин | 100% в первый день каждые 12 ч, затем каждые 24 ч | 100% в первый день каждые 12 ч, затем каждые 24 ч | 100% в первый день каждые 12 ч, затем каждые 24 ч | Не применяется |
| Тетрациклин | 100% каждые 6 ч | 100% каждые 12−24 ч | Не применяется | Не применяется |
| Хинолоны/Фторхинолоны | ||||
| Левофлоксацин | 100% каждые 12−24 ч | Нагрузочная доза, за-тем 50% каждые 24 ч | Нагрузочная доза, за-тем 25% каждые 24 ч | - |
| Ломефлоксацин | 100% каждые 24 ч | Нагрузочная доза 100%, затем 50% нагрузочной дозы каждые 24 ч | Нагрузочная доза 100%, затем 50% нагрузочной дозы каждые 24 ч | - |
| Моксифлоксацин | 100% каждые 24 ч | 100% каждые 24 ч | 100% каждые 24 ч | + |
| Норфлоксацин | 100% каждые 12 ч | 100% каждые 12−24 ч | 100% каждые 24 ч | - |
| Офлоксацин | 100% каждые 12 ч | 100% каждые 24 ч | 50% каждые 24 ч | - |
| Пефлоксацин | 100% каждые 12−24 ч | 100% каждые 12−24 ч | 100% каждые 12−24 ч | - |
| Спарфлоксацин | 100% в первый день, затем 50% каждые 24 ч | 100% в первый день, затем 50% каждые 48 ч | 100% в первый день, затем 50% каждые 48 ч | - |
| Ципрофлоксацин | 100% каждые 12 ч | 50−100% каждые 12−18 ч | 50% каждые 18−24 ч | - |
| Гликопептиды | ||||
| Ванкомицин | > 80 мл/мин — 100% каждые 6−12 ч 50−80 мл/мин — 100% 1 раз в каждые 24−72 ч |
100% 1 раз в каждые 3−7 дней | 100% 1 раз в каждые 7−14 дней | - |
| Тейкопланин | > 60 мл/мин — 100% каждые 24 ч.В диапазоне 40−60 мл/мин — 100% каждые 24 ч в течение 4 дней, затем 50% каждые 24 ч | < 40 мл/мин — 100% каждые 24 ч в течение 4 дней, затем 30% каждые 24 ч | 100% каждые 24 ч в течение 4 дней, затем 30% каждые 24 ч | - |
| Линкозамиды | ||||
| Клиндамицин | 100% каждые 6 ч | 100% каждые 6 ч | 100% каждые 6 ч | + |
| Линкомицин | 100% каждые 6 ч | 100% каждые 12 ч | 25−30% каждые 12 ч | + |
| Оксазолидиноны | ||||
| Линезолид | 100% каждые 12 ч | 100% каждые 12 ч | 100% каждые 12 ч | + |
| Нитроимидазолы | ||||
| Метронидазол | 100% каждые 6−8 ч | 100% каждые 8 ч | 50% каждые 8−12 ч | + |
| Орнидазол | 100% каждые 12 ч | 100% каждые 12 ч | 100% каждые 12 ч | - |
| Секнидазол | 100% по схеме | 100% по схеме | 50% по схеме | + |
| Тинидазол | 100% каждые 24 ч | 100% каждые 24 ч | 100% каждые 24 ч | + |
| Нитрофураны | ||||
| Нитрофурантоин | 100 % каждые 6 ч | Не применяется | Не применяется | Не применяется |
| Нифуроксазид | 100% каждые 6 ч | 100% каждые 6 ч | 100% каждые 6 ч | - |
| Нифурател | 100% каждые 8−12 ч | 100% каждые 8−12 ч | 100% каждые 12−24 ч | - |
| Фуразолидон | 100% каждые 6 ч | 100% каждые 6 ч | 100% каждые 6 ч | - |
| Полимиксины | ||||
| Полимиксин В | 1−1,5 мг/кг каждые 24 ч | 1−1,5 мг/кг каждые 48−72 ч | 1 мг/кг каждые 5 дней | - |
| Препараты других групп | ||||
| Хлорамфеникол | 100% каждые 6 ч | 100% каждые 6 ч | 100% каждые 6 ч | + |
| Спектиномицин | 100% однократно | 100% однократно | 100% однократно | - |
| Сульфаниламиды и ко-тримоксазол | ||||
| Сульфаниламиды и ко-тримоксазол |
100% | 50% | Не применяются | Не применяются |
| Противотуберкулезные препараты | ||||
| Изониазид | 100% каждые 24 ч | 100% каждые 24 ч | 100% каждые 24 ч | Не применяется |
| Капреомицин | 7−12,7 мг/кг каждые 24 ч | 3,6−5,9 мг/кг каждые 24 ч или 7,2−11,7 мг/кг каждые 48 ч | 1,3−2,4 мг/кг каждые 24 ч или 2,6−4,9 мг/кг каждые 48 ч или 3,9−7,3 мг/кг каждые 72 ч | - |
| Пиразинамид | 100% каждые 24 ч | 100% каждые 24 ч | 100% каждые 24 ч | Не применяется |
| Рифабутин | 100% каждые 12−24 ч | 100% каждые 12−24 ч | 100% каждые 12−24 ч | Не применяется |
| Рифампицин | 100% каждые 24 ч | 50−100% каждые 24 ч | 50% каждые 24 ч | Не применяется |
| Фтивазид | 100% каждые 12 ч | Не применяется | Не применяется | - |
| Этамбутол | 100% каждые 24 ч | 100% каждые 36 ч | 100% каждые 48 ч | - |
| Этионамид | 100% каждые 12 ч | 100% каждые 12 ч | 50% каждые 12 ч | + |
| Противогрибковые препараты | ||||
| Амфотерицин В | 100% каждые 24 ч | 100% каждые 24 ч | 100% каждые 36 ч | Не применяется |
| Гризеофульвин | 100% каждые 12 ч | 100% каждые 12 ч | 100% каждые 12 ч | Не применяется |
| Итраконазол | 100% каждые 12−24 ч | 100% каждые 12−24 ч | 50−100% каждые 12−24 ч | + |
| Кетоконазол | 100% каждые 12−24 ч | 100% каждые 12−24 ч | 100% каждые 12−24 ч | Не применяется |
| Натамицин | 100% каждые 6 ч | 100% каждые 6 ч | 100% каждые 6 ч | - |
| Нистатин | 100% каждые 6−8 ч | 100% каждые 6−8 ч | 100% каждые 6−8 ч | - |
| Флуконазол | 100% каждые 24 ч | 50% каждые 24 ч | 50% каждые 24 ч | + |
| Противовирусные препараты | ||||
| Абакавир | 100% каждые 12 ч | Нет данных | Нет данных | + |
| Амантадин | 100% каждые 12−24 ч | 100% каждые 48−72 ч | 100% один раз в 7 дней | + |
| Ампренавир | 100% каждые 12 ч | 100% каждые 12 ч | 100% каждые 12 ч | + |
| Ацикловир | 100% каждые 8 ч | 100% каждые 12−24 ч | 50% каждые 24 ч | - |
| Валацикловир | 100% каждые 8 ч | 100% каждые 12−24 ч | 50% каждые 24 ч | + |
| Ганцикловир | 100% по схеме | 25−50% каждые 24 ч | 25% 3 раза в неделю | - |
| Диданозин | 100% каждые 12 ч | 100% каждые 24 ч | 100% каждые 24−48 ч | + |
| Зальцитабин | 100% каждые 8 ч | 100% каждые 12 ч | 100% каждые 24 ч | + |
| Занамивир | 100% каждые 12 ч | 100% каждые 12 ч | 100% каждые 12 ч | - |
| Зидовудин | 100% каждые 8 ч | 100% каждые 8 ч | 50% каждые 12 ч | + |
| Индинавир | 100% каждые 12 ч | 100% каждые 12 ч | 100% каждые 12 ч | + |
| Интерферон альфа | 100% по схеме | 50−100% по схеме | Не применяется | + |
| Ифавиренц | 100% каждые 24 ч | 100% каждые 24 ч | 100% каждые 24 ч | + |
| Ламивудин | 100% каждые 12 ч | 75−100% однократно | 15−30% однократно | - |
| Невирапин | 100% по схеме | Нет данных | Нет данных | Нет данных |
| Нельфинавир | 100% по схеме | 100% по схеме | 100% по схеме | + |
| Озельтамивир | 100% каждые 12 ч | 50% каждые 24 ч | Не применяется | - |
| Пегинтерферон альфа | 100% по схеме | 50−100% по схеме | Нет данных | Не применяется |
| Рибавирин | 100% по схеме | 100% по схеме | 50% по схеме | - |
| Римантадин | 100% по схеме | 100% по схеме | 50% по схеме | + |
| Ритонавир | 100% каждые 12 ч | 100% каждые 12 ч | 100% каждые 12 ч | + |
| Саквинавир | 100% каждые 8 ч | 100% каждые 8 ч | 100% каждые 8 ч | + |
| Ставудин | 100% каждые 12 ч | 50% каждые 12 ч | 50% каждые 24 ч | + |
| Фамцикловир | 100% каждые 8 ч | 50−100% каждые 12−48 ч | 50% каждые 48 ч | - |
| Фоскарнет | 100% каждые 8−12 ч | 50% каждые 12 ч | 50% каждые 24 ч | - |
| Фосфазид | 100% по схеме | Нет данных | Нет данных | Нет данных |
| Противопротозойные препараты | ||||
| Артемизинин и его производные | 100% по схеме | 100% по схеме | 100% по схеме | + |
| Галофантрин | 100% по схеме | 100% по схеме | 100% по схеме | + |
| Дегидроэметинадигидрохлорид | 100% по схеме | 100% по схеме | 100% по схеме | + |
| Меглюминаантимонат | 100% по схеме | Не применяется | Не применяется | Не применяется |
| Мефлохин | 100% по схеме | 100% по схеме | 100% по схеме | + |
| Паромомицин | 100% по схеме | 100% по схеме | 100% по схеме | - |
| Пириметамин | 100% по схеме | 100% по схеме | 100% по схеме | + |
| Пириметамин/сульфадоксин | 100% по схеме | 100% по схеме | 100% по схеме | + |
| Примахин | 100% по схеме | 100% по схеме | 100% по схеме | + |
| Прогуанил | 100% по схеме | 100% по схеме | 50% по схеме | + |
| Хинин | 100% каждые 8 ч | 100% каждые 8−12 ч | 100% каждые 24 ч | + |
| Хлорохин | 100% по схеме | 100% по схеме | 50% по схеме | + |
| Эметина гидрохлорид | 100% по схеме | 100% по схеме | 100% по схеме | Не применяется |
| Этофамид | 100% каждые 12 ч | 50% каждые 12 ч | 50% каждые 12−24 ч | - |
| Противогельминтные препараты | ||||
| Албендазол | 100% каждые 12 ч | 100% каждые 12 ч | 100% каждые 12 ч | + |
| Диэтилкарбамазин | 100% по схеме | 50% по схеме | Не применяется | - |
| Ивермектин | 100% по схеме | 100% по схеме | 100% по схеме | + |
| Левамизол | 100% по схеме | 100% по схеме | 100% по схеме | - |
| Мебендазол | 100% по схеме | 100% по схеме | 100% по схеме | Не применяется |
| Никлозамид | 100% по схеме | Не применяется | Не применяется | + |
| Пирантелапамоат | 100% по схеме | 100% по схеме | 100% по схеме | + |
| Празиквантел | 100% по схеме | 100% по схеме | 100% по схеме | - |
* Проценты указаны по отношению к разовой дозе
** «+» — требуется коррекция дозы, при тяжелой печеночной недостаточности целесообразно воздержаться от применения препарата
«-» — изменения дозировки не требуется
Не применяется — противопоказан при нарушениях функции печени
Клиренс креатинина у мужчин может быть рассчитан по формуле:
| Клиренс креатинина (мл/мин) = | (140 — возраст) x идеальная масса тела (кг) 0.8 x креатинин сыворотки крови (мкмоль/л) |
Клиренс креатинина для женщин = 0,85 x клиренс креатинина для мужчин
По материалам antibiotic.ru
Дилатационная кардиомиопатия
Дилатационная кардиомиопатия представляет собой болезнь, при которой наблюдается расширение полостей сердца, дисфункция желудочков. 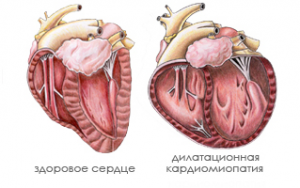 При этом нарушается сократительная способность органа, что влечет массу сопутствующих последствий, в частности, хроническую сердечную недостаточность.
При этом нарушается сократительная способность органа, что влечет массу сопутствующих последствий, в частности, хроническую сердечную недостаточность.
Важно! Диагноз — дилатационная кардиомиопатия встречается в историях болезни приблизительно 60% пациентов, у которых определенакардиомиопатия. При этом развивается болезнь преимущественно в возрасте 20−50 лет. Но есть такие случаи, когда может диагностироваться ДКМП у детей и пожилых людей. В любом случае среди тех, у кого обнаружена эта болезнь, преобладающее большинство — мужчины.
Говоря о причинах развития дилатационной кардиомиопатии, стоит отметить, что точно перечислить их не сможет ни один доктор. Есть только негативные факторы, повышающие вероятность появления болезни, а также данные статистики. Например, исследования показывают, что примерно в 30% случаев наблюдается наследственная расположенность человека к сердечным заболеваниям — у его родственников тоже имеются подобные диагнозы. Также в анамнезе 30% пациентов от общего их числа имеется злоупотребление алкоголем. Связь объясняется очень просто. Этанол оказывает токсическое воздействие на миокард, нарушая его функции. В группе риска находятся и люди, работающие на вредных производствах, систематически вдыхающие промышленную пыль, различные химические вещества. Помимо этого, развитию заболевания подвержены и люди, чей рацион однообразен и содержит недостаточное количество витаминов и микроэлементов, а также те, кто ведет малоподвижный образ жизни.
Несмотря на такое количество негативных факторов, очень часто все-таки не удается определить точную причину развития болезни, тогда в истории болезни пациента прописывают диагноз — идиопатическая дилатационнаякардиомиопатия.
Клинические проявления
На начальной стадии развития заболевание протекает бессимптомно. Это и усложняет его раннюю диагностику. Но, через некоторый промежуток времени начинают проявляться первые признаки проблем со здоровьем, это могут быть:
- ноющие боли в области сердца;
- головокружение;
- одышка;
- сухой кашель;
- нарушения ЧСС;
- отечность ног;
- тяжесть в правом подреберье;
- быстрая утомляемость.
Если наблюдаются перечисленные симптомы дилатационной кардиомиопатии или часть из них, необходимо срочно обратиться за медицинской помощью. Своевременное лечение поможет избавиться от заболевания, избегая его последствий.
Диагностика, как она проводится
Первым делом человеку предстоит пройти диагностику. Она состоит из стандартного перечня исследований, заключается в следующем:
- электрокардиография — это исследование не позволяет поставить диагноз ДКПМ без дополнительного обследования, но показывает нарушения в работе сердца, частоте его сокращений, позволяя заподозрить наличие серьезной проблемы;
- эхокардиография — такой метод считается более информативным, позволяет выявить дисфункцию желудочков, а также определить изменения в структуре органа. Именно в ходе выполнения эхокардиографии чаще всего врачи выдвигают предположение о том, что у человека имеет место ДКПМ;
- рентгенография — показывает структурные изменения в сердце.
Когда речь идет о серьезных случаях, где принимается решение об актуальности хирургического вмешательства, возможно проведение дополнительного обследования. Оно будет заключаться в выполнении коронароангиографии и вентрикулографии. Также может быть показана эндомиокардиальная биопсия. Последняя позволяет определить прогноз при дилатационной кардиомиопатии.
После того, как диагноз установлен, может идти речь о лечении заболевания, тактика которого определяется в каждом случае индивидуально.
Особенности лечения
Сразу стоит отметить, что лечение ДКМП народными средствами абсолютно бесполезно и даже опасно, поэтому назначать терапию может только врач. Первым делом рассматривается целесообразность применения консервативной терапии. Она будет состоять из нескольких групп препаратов, каждая из которых выполняет свои важные функции:
- ингибиторы АПФ — их назначают пациентам независимо от стадии, на которой находится заболевание. Они предотвращают некроз кардиомиоцитов. Ингибиторы содействуют обратному развитию гипертрофии. Также препараты облегчают общее состояние человека. Но, прием врачи рекомендуют начинать с минимальных дозировок во избежание гипотонии;
- бета-адреноблокаторы — эти препараты необходимы для нормализации ЧСС. Они применяются в комплексном сочетании с ингибиторами АПФ, отличаются высокой эффективностью. ЛСпродлевают жизнь пациента, существенно повышая ее качество. Терапия начинается с минимальных доз;
- диуретики — их применение целесообразно при застое крови в легких или большом круге кровообращения. Такие препараты могут комбинироваться с антагонистами альдостерона или нитратами;
- сердечные гликозиды — нормализуют ЧСС, устраняют симптомы застоя крови в легких. После начала их приема исчезает одышка, а также другие симптомы недуга.
Это основная программа лечения дилатационной кардиомиопатии. Но, иногда медикаментозная терапия может не давать желаемого эффекта, тогда будет идти речь о хирургическом вмешательстве, предполагающем трансплантацию сердца. Обычно ее выполняют при стремительно прогрессирующей сердечной недостаточности, а также в тех случаях, когда наблюдается высокий риск осложнений, представляющих опасность для жизни, например, тромбоэмболических.
Для того чтобы предотвратить развитие дилатационной кардиомиопатии, следует соблюдать рекомендации по ее профилактике. Это правильное сбалансированное питание, активный образ жизни, исключение вредных привычек, соблюдение режима труда и отдыха. Тем, кто имеет наследственную расположенность, следует систематически проходить обследование у кардиолога, чтобы получать информацию о состоянии собственного здоровья.
По материалам infocardio.ru
