Широкая распространенность низкой плазменной концентрации тиамина при сахарном диабете, связь с маркерами сосудистой дисфункции
П. Дж. Торнелли*, Р. Бабаи-Джадиди*, Х. Аль Али* и др.
*Кафедра биологических наук, Университет Эссекса, Колчестер, Великобритания
Журнал «Диабетология», 2007 г., 50: стр. 2164—2170
Резюме
Цели/гипотеза
Оценка содержания тиамина с помощью анализа плазмы крови, эритроцитов и мочи при 1 и 2 типах сахарного диабета (СД) и выявление связи с маркерами сосудистой дисфункции.
Методы
В исследовании приняли участие пациенты с СД (26 — с типом 1 и 48 — с типом 2) с микроальбуминурией и без нее и 20 здоровых волонтеров. Определялись активность эритроцитарной транскетолазы, концентрация тиамина и сопряженных фосфорилированных метаболитов в плазме крови, эритроцитах и моче, маркеры метаболического контроля и сосудистой дисфункции.
Результаты
Концентрация тиамина плазмы крови оказалась сниженной у 76% пациентов с 1 типом СД и 75% со 2 типом СД и составила: здоровые волонтеры 64,1 нмоль/л (95% ДИ 58,5−69,7), 1 тип СД 15,3 нмоль/л (95% ДИ 11,5−19,1), р<0,001, и 2 тип СД 16,3 нмоль/л (95% ДИ 13,0−9,6), р<0,001.
Почечный клиренс тиамина увеличился в 24 раза у пациентов с СД 1 типа и в 16 раз — у пациентов со 2 типом СД. Выявлена отрицательная корреляция концентрации тиамина в плазме крови с почечным клиренсом тиамина (r=-0,531, p<0,001) и фракционной экскрецией тиамина (r=-0,616, p<0,001), а также активности транскетолазы эритроцитов с экскрецией белка с мочой (r=-0,232, p<0,05). У пациентов с СД 1 и 2 типов отмечено увеличение содержания белка-переносчика тиамина в мембране эритроцитов. Также выявлена отрицательная корреляция концентрация тиамина в плазме крови и экскреция тиамина с мочой с содержанием растворимых сосудистых молекул адгезии — 1 (r=-0,246, p<0,05 и —0,311, p<0,01 соответственно).
Заключение/интерпретация
Низкая концентрация тиамина в плазме крови широко распространена у пациентов с СД 1 и 2 типов, что связано с повышенным клиренсом тиамина. Традиционная оценка содержания тиамина была затруднена в связи с увеличенным содержанием переносчика тиамина в эритроцитах.
Введение
Распространенность СД в Великобритании, как и во всем мире, растет в геометрической прогрессии. Для предотвращения развития сосудистых осложнений при СД (микроваскулярных — нефропатия, ретинопатия и периферическая нейропатия; макроваскулярных — кардио- васкулярные заболевания и инсульты) наиболее важен жесткий контроль глюкозы крови, артериального давления и липидного профиля. Однако это не всегда возможно из-за ограниченных возможностей существующих на сегодняшний день медикаментозных средств, комплайенса пациентов и ряда других факторов. Значительный резидуальный риск развития микро- и макроваскулярных осложнений в проспективных клинических исследованиях, в которых были предприняты попытки оптимизации контроля гликемии, и несостоятельность большинства подозреваемых генетических факторов восприимчивости к осложнениям повлекли за собой поиск других метаболических и нутритивных факторов, предрасполагающих к развитию сосудистых осложнений при СД.
Сосудистые осложнения прогрессируют через 5−40 лет после начала диабета, хотя они могут появиться раньше при СД 2 типа, что связано с периодом недиагностированного СД и нарушения толерантности к глюкозе (НТГ). Стратегия предотвращения активации патологических путей возникновения биохимических дисфункций, ведущих к развитию сосудистых осложнений, основана на последних данных о клеточной биологии осложнений при СД: это высокодозовая терапия тиамином и его производными, такими как бенфотиамин. Терапия высокими дозами тиамина предотвратила развитие микроваскулярных осложнений при экспериментальном СД без улучшения метаболического контроля.
Экспериментальный CД также был ассоциирован с дефицитом специфического тканевого тиамина, который характеризовался значительным снижением плазменной концентрации тиамина, активности тиамин-зависимого фермента транскетолазы (ТК) и уровня белка ТК в почечных клубочках, что связано со значительным увеличением почечного клиренса тиамина (Cl тиамина). Дефицит тиамина не был выявлен стандартным методом, эритроцитарным «тиаминовым эффектом» (процент несатурированного ТК кофактором тиамина пирофосфатом [ТПФ]). Широкое распространение низкой плазменной концентрации тиамина и нарушенное выведение тиамина почками при СД ранее не обсуждались.
В данном исследовании мы пытались установить, происходит ли нарушение гомеостаза тиамина при СД 1 и 2 типов и связано ли это с развивающейся нефропатией и маркерами сосудистой дисфункции и ранними стадиями почечной недостаточности.
Методы
Пациенты и здоровые волонтеры
Пациенты с СД набирались из Диабетической клиники, а здоровые волонтеры — из числа коллег и друзей пациентов и исследователей. Критерии включения: пациенты, страдающие СД, с нормоальбуминурией (AER — Albumine Excretion Rate — скорость экскреции альбумина <30 мг/сут) и микроальбуминурией (AER<30−300 мг/сут), сходные по полу и возрасту (18−65 лет), продолжительность СД ≥5 лет, HbA1c <10%, и индексом массы тела (ИМТ) 19−40 кг/м2. Критерии исключения: пациенты с заболеваниями почек последней стадии, злоупотребление алкоголем (>50 U в неделю, 1 U — 8 г алкоголя), тяжелое сопутствующее заболевание, установленная аллергия или непереносимость тиамина, прием добавок тиамина или гидрастиса канадского (Hydrastis Cana densis, травяной сбор), участие в другом исследовании в последние 30 дней, опреация по пересадке почки и/или поджелудочной железы в анамнезе, беременные или кормящие женщины или женщины, не получающие адекватную контрацептивную терапию. При подписании информированного согласия пациентам и волонтерам выполнялись 24-часовой сбор мочи, анализы крови (натощак). Плазма, эритроциты и фракция мононуклеарных лейкоцитов (МНЛ) были незамедлительно заморожены при температуре — 80°С до выполнения анализа. Этическое одобрение исследования было дано местным этическим комитетом (местный исследовательский этический комитет Северного и Среднего Эссекса).
Изучение тиамина и фосфорилированных метаболитов
Содержание тиамина оценивалось путем измерения концентраций тиамина, тиамина монофосфата (ТМФ) и ТПФ, определенных с помощью ВЭЖХ с флуометрической детекцией. Время ретенции, границы обнаружения, межгрупповые значения СV и восстановление для этих метаболитов составили: тиамин 13,1 мин, 36 фемтомоль (фмоль), 1,1 и 97%, ТМФ 6,0 мин, 52 фмоль, 2,1 и 92%, и ТПФ 4,5 мин, 51 фмоль, 2,9 и 94%. Гликемия крови не влияла на полученные результаты, которые значимо не различались между здоровыми волонтерами и пациентами с СД. Исследование сохраненных образцов выявило, что анализируемые вещества оставались стабильными в плазме, эритроцитах и моче, замороженных при температуре —80°С, в течение не менее 6 недель и в плазме, гемолизате эритроцитов и моче, а также их депротеиназных экстрактах в течение 8 часов. Растворы тиамина, ТМФ и ТПФ калибровались путем спектрофотомерии, устанавливался молярный коэффициент: ε233=14,2, ε247=15,3 и ε247=13,0 (моль/л) —1 см-1, соответственно. Анализ Shewhart, оценивающий стабильность анализируемых веществ в образцах каждый день в течение 10 дней, показал приемлемый контроль качества (все значения представлены в виде среднего значения±2 квадратичных отклонения — КО). Контролировались концентрация метаболитов тиамина в плазме крови, эритроцитах и моче, а также Cl тиамина и фракционная экскреция тиамина (ФЭ тиамина).
Другие биохимические параметры
Определялись эритроцитарная активность ТК и процент несатурированного ТПФ (эффект тиамина). Содержание в мембране эритроцита переносчика-1 тиамина (THTR-1) и переносчика-1 фолата (RFC-1), переносчика ТМФ определялось с помощью SDS-PAGE электрофореза и блотирования, нормализации интенсивности соединения β-актина и подготовка экстракта белков мембраны эритроцитов с помощью оптимальной процедуры и антител к THTR-1 и RFC-1 (альфа Диагностика, Сан Антонио, США).
Определялись маркеры метаболического контроля: глюкоза плазмы крови, HbA1c, общий холестерин, холестерин ЛПВП, триглицериды, систолическое и диастолическое артериальное давление и скорость клубочковой фильтрации (СКФ), вычисленная по клиренсу креатинина, скорректированному по формуле Cockcroft-Gault. Маркеры сосудистой и метаболической дисфункции (ингибитор-1 плазменного активатора плазминогена, фактор Виллебранда и растворимые сосудистые молекулы адгезии-1 [sVCAM-1], и МНЛ протеинкиназа С определялись с помощью ELISA (Техноклон, Доркинг, Великобритания; R&D Systems, Абингдон, Великобритания; и Stressgen, Анн Арбор, США, соответственно).
Статистичекий анализ
Значимость различий между средними и медианами анализируемых концентраций определялась с использованием теста Стьюдента t и теста Mann-Whitney U, соответственно, корреляционный анализ выполнялся с помощью статистики Спермана ρ. Все данные представлены в виде среднего значения±КО или медианы (минимум-максимум).
Результаты
Характеристика пациентов
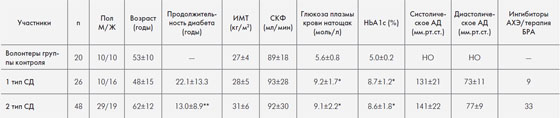
Характеристика пациентов с СД 1 и 2 типов и здоровых волонтеров, включенных в исследование, представлена в таблице 1. У пациентов с СД был удовлетворительный контроль гликемии, среднее HbA1c составило 8,6−8,7%. СКФ было в пределах нормы. У 50 пациентов с СД (17 с 1 типом и 33 со 2 типом) экскреция альбумина с мочой не выходила за пределы нормальных значений (медиана — 11,5, 2,3−29,1 мг/сут), у 24 наблюдалась микроальбуминурия и начинающаяся нефропатия (медиана 46,1, 30,6−297,3 мг/сут). У пациентов с СД с и без микроальбуминурии были сходны возраст (60±14 против 56±15 лет), длительность диабета (17±11 против 16±12 лет) и уровень HbA1c (8,9±1,9 против 8,5±1,5%). 9 пациентов с СД 1 типа и 33 с СД 2 типа получали терапию ингибиторами ацетилхолинэстеразы (АХЭ) или блокаторами рецепторов к ангиотензину (БРА).
Таблица 1. Характеристика здоровых волонтеров и пациентов, страдающих СД, включенных в исследование
Данные представлены в виде среднего значения ± КО
НО — не определялось
* р <0,001 по отношению к здоровым волонтерам
** р <0,01 по отношению к пациентам с 1 типом СД (тест Манна-Витни U).
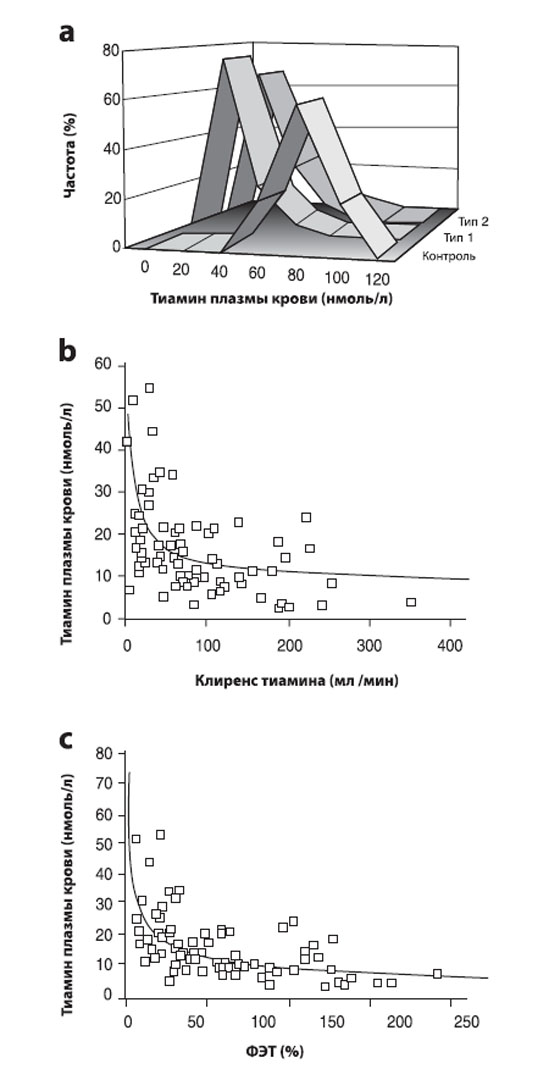
Рисунок 1. Содержание тиамина у пациентов с СД и связь с растворимыми сосудистыми молекулами адгезии 1 (sVCAM1).
a. Частотный график плазменной концентрации тиамина.
b. Обратно пропорциональная зависисимость между плазменной концентрацией тиамина и Cl тиамина. Нелинейное регрессионное уравнение:
[Тиамин]плазма=47,7*Cl тиамина — 0,274, р<0,001.
с. Обратно пропорциональная зависимость между плазменной концентрацией тиамина и фракционной экскрецией тиамина (ФЭТ). Нелинейное регрессионное уравнение: [Тиамин]плазма=74,0*ФЭТ — 0,448, р<0,001.
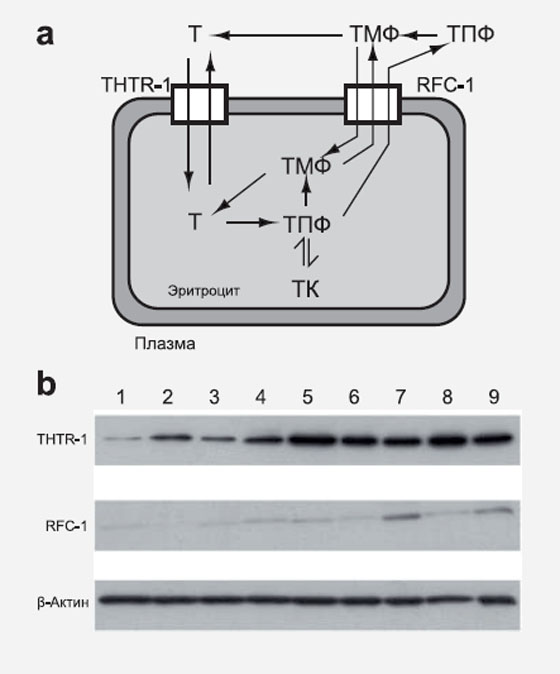
Рисунок 2.
a. Схематичная диаграмма трансмембранного транспорта тиамина и его метаболизма в эритроцитах.
b. Репрезентативный блот Western THTR-1, RFC-1 и β-актина мембраны эритроцитов. «Дорожки» 1−3 — здоровые волонтеры, 4−6 — пациенты с 1 типом СД, 7−9 — пациенты со 2 типом СД.
Содержание тиамина у пациентов с СД 1 и 2 типа
При оценке статуса тиамина в исследуемой группе и среди здоровых волонтеров, было обнаружено снижение плазменной концентрации тиамина у 76% и 75% пациентов с 1 и 2 типами СД соответственно. Плазменная концентрация тиамина (среднее значе-ние ± КО) составило: для здоровых волонтеров 64,1± 12,0 нмоль/л, для пациентов с СД 1 типа 15,3±9,6 нмоль/л и 2 типа —16,3±11,5 нмоль/л, р <0,001 (тест Стьюдента t) (рис.1а). Не выявлено значимой разницы между плазменной концентрацией тиамина у пациентов с 1 и 2 типами СД или между пациентами с СД с микроальбуминурией или без нее (14,4±8,9 против 16,7±11,6 нмоль/л, р >0,05). Эксреция тиамина с мочой увеличивалась в 4 раза и в 3 раза при 1 и 2 типах СД по сравнению со здоровыми волонтерами. Экскреция тиамина с мочой (среднее значение, минимум-максимум) составило: для здоровых волонтеров 0,31 (0,23−2,45) μмоль/ сут, при 1 типе СД — 1,36 (0,39−7,65) μмоль/сут, и 2 типе СД 1,04 (0,08−6,85) μмоль/сут, р<0,001 (тест Mann- Whitney U). Эксреция тиамина с мочой была выше при 1 типе СД, чем при 2 (р <0,05), но значимо не отличалось между пациентами с микроальбуминурией или без нее [1,10 (0,08–7,65) против 1,23 (0,33–6,85) μмоль/л/сут, р>0,05]. Cl тиамина увеличивался в 24 раза у пациентов с 1 типом СД и в 16 раз — со 2 типом. Cl тиамина (среднее значение, минимум-максимум) составил: у здоровых волонтеров 3,7 (2,6−26,2) мл/мин; при СД 1 типа 86,5 (12,8−228,4) мл/ мин; и 2 типа 59,8 (91,4−256,6) мл/мин, р <0,001 (тест Mann-Whitney U). Не выявлено значимых различий в Cl тиамина между пациентами с СД с микроальбуминурией или без нее (72,9 [1,4-355,7] против 66,3 [5,8-245,3] мл/мин). ФЭ тиамина увеличился в 25 раз при 1 типе СД и в 15 раз при 2. ФЭ тиамина (среднее, минимум-максимум) составило: у здоровых волонтеров 2,8% (1,4−17,2%); при СД 1 типа 71,2% (7,6−165,9%); и 2 типа 41,6% (1,1−228,9%), р <0,001(тест Mann-Whitney U). Не выявлено значимых различий в ФЭ тиамина между пациентами с СД с микроальбуминурией и без нее (57,7% [8,0–228,9%] против 43,4% [1,1–165,9%]). Концентрация тиамина плазмы крови отрицательно коррелировала с Cl тиамина (r=-0,531, р <0,001, Spearman) и ФЭ тиамина (r=-0,616, р <0,001, Spearman) (рис.1 b,c). Не выявлено значимых различий в параметрах, связанных с тиамином, между пациентами с СД и с и без терапии АХЭ или БРА.
Дефицит тиамина устанавливается путем измерения активности ТК эритроцитов. Эритроцитарная активность ТК значительно не изменялась у пациентов с СД по сравнению со здоровыми волонтерами. Активность ТК составила: у здоровых волонтеров 1,09±0,06 ЕД/мг Hb; при 1 типе 1,18 ±0,25 Ед/мг Hb; при 2 типе СД 1,01±0,17 Ед/ мг Hb.
Эритроцитарная активность ТК также достоверно не различалась между пациентами с СД с микроальбуминурией и без нее (1,03±0,24 против 1,08±0,21 Ед/мг Hb), хотя наблюдалась отрицательная корреляция с экскрецией альбумина с мочой (r=-0,232, р<0,05, Spearman). У всех пациентов не выявлен дефицит тиамина в соответствии с дефиницией «эффект тиамина» (который составил менее 15%). Концентрация тиамина в эритроцитах не изменялась значимо у пациентов с 1 и 2 типами СД по сравнению со здоровыми волонтерами. Концентрация тиамина в эритроцитах (среднее значение ±КО) составила: у здоровых волонтеров 0,318±0,028 pmol/мг Hb, при 1 типе СД 0,345 ±0,025 pmol/мг Hb, при 2 типе СД 0,328±0,137 pmol/мг Hb.
«Маскировка» дефицита тиамина в эритроцитах повышенным содержанием белков-переносчиков ти- амина
Мы пытались понять, как в эритроцитах пациентов с СД поддерживалась нормальная концентрация тиамина, в то время как плазменная концентрация тиамина была значительно снижена. Транспорт тиамина и ТМФ из плазмы в эритроциты происходит с помощью транспортных белков THTR-1 и RFC-1 соответственно (рис.2а). С помощью метода Вестерн-блот выявлено повышение содержания белков-переносчиков эритроцитарной мембраны у пациентов с СД по сравнению с мембран-ассоциированным белком β-актином (рис.2b). Переносчики тиамина: содержание β-актина (среднее значение, минимум-максимум): у здоровых волонтеров (n=10), THTR- 1 0,69 (0,12−1,43) и RFC-1 0,042 (0,012−0,093), при 1 типе СД (n=12), THTR-1 1,06 (0,64−2,02) (+54%, р<0,05) и RFC-1 0,146 (0,021−0,902) (+248%, р<0,01), и при 2 типе СД (n=12), THTR-1 1,20 (0,62−2,39) (+74%, р<0,01) и RFC-1 0,206 (0,038−1,382) (+390%, р<0,01) (тесты Mann- Whitney U).
Низкая плазменная концентрация тиамина и маркеры метаболического контроля и сосудистая дисфункция
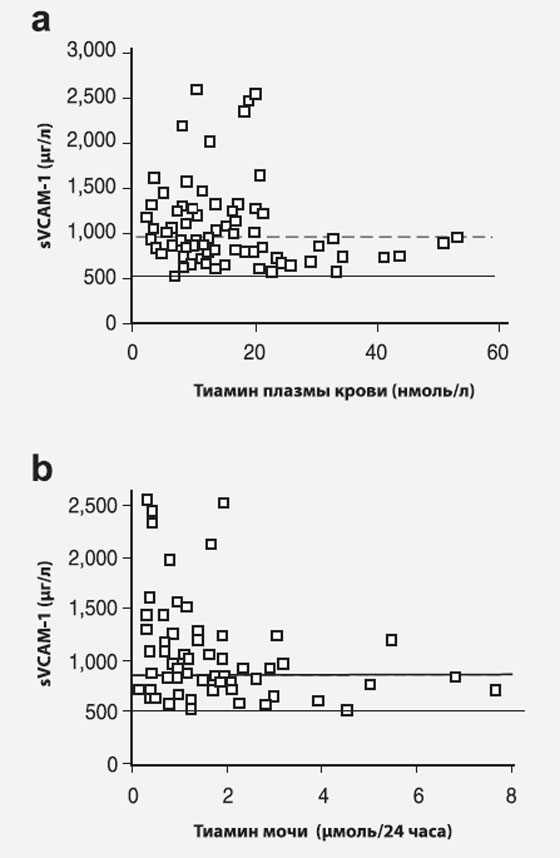
Мы изучали маркеры метаболического контроля и сосудистой дисфункции при диабете для выявления их взаимосвязи с низкой плазменной концентрацией тиамина при диабете. Единственной достоверной была корреляция плазменной концентрации тиамина с содержанием в плазме sVCAM1 (r=-0,246, р<0,05, Spearman) (рис. 3а) и экскреции тиамина с мочой с содержанием в плазме sVCAM1 (r=-0,311, р<0,01) (рис. 3b).
Обсуждение
В данном исследовании мы выявили, что СД ассоциирован со значительным дефицитом тиамина в плазме крови, что связано с повышением Cl тиамина и ФЭТ. Наблюдается обратно пропорциональная зависимость между низкой плазменной концентрацией тиамина при СД и содержанием в плазме крови sVCAM-1.
Ценность данного исследования состоит в том, что в нем использовались одобренные методы оценки содержания тиамина и фосфорилированных метаболитов, проводилось всестороннее изучение связанных с тиамином субстанций (включая содержание белков-переносчиков тиамина в мембранах эритроцитов, экскрецию с мочой, Cl тиамина и ФЭТ) и их взаимосвязь с маркерами метаболической и сосудистой дисфункции. Снижение плазменной концентрации тиамина при СД вероятно не было связано напрямую с недостаточным поступлением тиамина с пищей. Экскреция тиамина с мочой у пациентов с СД и здоровых волонтеров была в пределах нормы (>0,20 μмоль/сут), кроме пациентов с СД 2 типа — 0,08 μмоль/сут. Экскреция тиамина с мочой играет второстепенную роль в нормальном обороте тиамина в организме: пиримидиновые и тиазоловые продукты деградации тиамина также экскретируются с мочой и именно они составляют большую часть оборота тиамина. Больше того, низкие плазменные концентрации тиамина связаны со значительным увеличением Cl тиамина и ФЭТ. Молекулярная масса тиамина менее 500 Дальтон, и поэтому он фильтруется из плазмы в почечный клубочек. Повышенный Cl тиамина возможно связан со снижением повторного захвата тиамина в проксимальных почечных канальцах. Cl тиамина был нарушен у пациентов с СД с нормальной СКФ. В данном исследовании предполагается, что нарушение почечной фильтрации тиамина у пациентов с СД является ранним маркером почечной недостаточности при СД, связанным с повреждением места повторного захвата тиамина в почках, что в особенности относится к проксимальным канальцам.
Рисунок 3. Корреляция sVCAM-1 с плазменной концентрацией тиамина (а) и экскрецией тиамина с мочой (b). Непррерывная горизонтальная линия показывает референтные значения sVCAM-1 у здоровых волонтеров, пунктирная — у верхнюю границу sVCAM-1 у здоровых волонтеров.
Повторный захват тиамина происходит в проксимальных почечных канальцах белками-переносчиками тиамина THTR-1 и THTR-2 через натрий-независимый протонный механизм с регуляцией Са2+/кальмодулином. Экспрессия генов, кодирующих THTR-1 и THTR-2 (а также RFC-1), регулируется через участки SР1. SР1 сигнализируют о повреждении канальцевого эпителия при гипергликемии (при СД) путем повышения О- гликозилирования SР1 через повышение активности гексозаминового пути утилизации глюкозы. Повторный захват тиамина канальцевым эпителием при экспериментальном и клиническом СД может нарушаться в связи с подавлением (из-за активации гексозаминового пути) экспрессии генов, кодирующих THTR-1 и THTR-2, ингибированием этих белков-переносчиков гликированием дикарбонилов и закислением поверхности канальца.
Недостатком данного исследования является то, что не наблюдалось сильной связи с установленной клинической конечной точкой, такой как развивающаяся нефропатия, оцениваемой по микроальбуминурии, хотя выявлена слабая отрицательная корреляция между активностью ТК эритроцитов и экскрецией альбумина с мочой. Важно, что экскреция альбумина с мочой более не является столь надежным маркером снижения почечной функции на ранних стадиях СД. Требуется более детальное изучение связи между изменениями гомеостаза тиамина и ранним снижением СКФ, оцениваемой по уровню цистатина С.
Ранее в работах с маленькой выборкой сообщалось о снижении плазменной концентрации тиамина при СД. Однако не производилась оценка и взаимосвязь клиренса тиамина и ФЭТ, содержания тиамина и переносчика ТМФ, содержащихся в мембране эритроцита, и плазменных sVCAM-1. Дефицит тиамина обычно устанавливается путем измерения процента несатурированной ТПФ-кофактором ТК в эритроцитах. Однако затем было выявлено, что дефицит тиамина в плазме крови при СД «маскируется» в эритроцитах повышенным уровнем THTR-1и RFC-1.
В связи со снижением способности эритроцитов синтезировать белок, повышение содержания белков− переносчиков происходит путем увеличения экспрессии генов, кодирующих THTR-1и RFC-1, в эритроцитарных предшественниках, ретикулоцитах и эритробластах. В действительности, повышенный уровень белков-переносчиков THTR-1 и RFC-1 также был выявлен в МНЛ у этих пациентов. Повышенние экспрессии генов, кодирующих переносчики тиамина, и уровня белков — это ответ на дефицит тиамина, что согласуется с низкой плазменной концентрацией тиамина, которая остается нераспознанной. Данное исследование показывает, что измерение «эффекта тиамина», основанного на активности эритроцитарной ТК, — это неадекватная оценка содержания тиамина.
Низкая плазменная концентрация тиамина при СД могла быть не столь значима, если бы ткани могли регулировать экспрессию генов и уровень белков-переносчиков тиамина, а также поддерживать нормальную активность ТК. Это происходит при нормальном уровне глюкозы крови. Последние работы с экспериментальным диабетом показали, что такой регуляции в почечном клубочке не возникает при СД, при котором стимуляция гексозаминового пути может блокировать повышенную экспрессию генов, кодирующих THTR-1, THTR-2 и RFC-1 и уровень их белков. В клубочках, пораженных при диабете, активность ТК и уровень белка ТК снижалась на 60%, и сходное нарушение захвата тиамина и метаболизма может возникнуть в сетчатке и периферических нервах.
Действительно, у RFC-1 наблюдается нарушенные экспрессия генов и уровень белков в диабетической сетчатке.
Сниженное содержание тиамина в клетках сосудов при СД усугубляет метаболическую дисфункцию при гипергликемии. Повышенный уровень sVCAM-1 — маркер эндотелиальной дисфункции и повышенного риска атеросклероза.
Уровень sVCAM-1 был повышен у пациентов с СД и нормальной почечной функцией, что было связано с микро- и макроваскулярными осложнениями при СД, хотя связь с контролем гликемии менее достоверна. Низкая плазменная концентрация тиамина может быть отягощающим фактором, связанным с повышенным уровнем sVCAM-1 при СД.
По результатам данного исследования, у пациентов в Соединенном Королевстве с СД 1 и 2 типов выявлена низкая плазменная концентрация тиамина. Стандартный метод определения содержания тиамина (по активности ТК эритроцитов) может быть неинформативным в связи с повышением уровня белков-переносчиков тиамина и ТМФ, THTR-1 и RFC-1 при СД. Дефицит тиамина при СД может увеличить восприимчивость клеток сосудов к побочным эффектам гипергликемии и таким образом повышать риск развития микроваскулярных осложнений. Коррекция низкой плазменной концентрации тиамина путем дополнительного приема тиамина может снизить риск микроваскулярных осложнений при СД.
Важными направлениями для дальнейших исследований являются:
1) Подтверждение наличия низкой плазменной концентрации тиамина у пациентов с СД в других странах вне зависимости от национальных особенностей диеты и методов приготовления пищи.
2) Определение важности использования тиамина и заменителей тиамина для коррекции плазменной концентрации тиамина при СД, обратного развития сосудистой дисфункции и предотвращения сосудистых осложнений.
3) Исследование механизма повышения клиренса тиамина при СД.